Blog Archives
Neues vom MDC
Der Bildgeber
Was haben Opernsänger*innen mit medizinischer Bildgebung zu tun? Einiges – wenn man Professor Thoralf Niendorf zuhört. Der Physiker erforscht die Potenziale der Ultrahochfeld-Magnetresonanztomographie (UHF-MRT). Deren Magnetfeldstärke liegt um Größenordnungen über denen der MRT-Scanner, die man aus der Klinik kennt. „Es gab anfangs erhebliche Zweifel, ob sich Ultrahochfeld-Geräte für Herzuntersuchungen eignen“, erinnert er sich. Schließlich bewegt sich das schlagende Herz.
Um diese Bewegung abzubilden, werden im MRT normalerweise die elektrischen Impulse des Herzmuskels mit einem Elektrokardiogramm (EKG) gemessen. Die Störsignale sind bei einer Magnetfeldstärke von 7.0 Tesla aber so stark, dass das MRT-System die EKG-Signale nicht mehr eindeutig erkennt. „Deshalb ist die Forschung weltweit zunächst daran gescheitert, Herzen im 7-Tesla-MRT scharf abzubilden“, erklärt Niendorf. Bis die Oper ins Spiel kam.
Physiological Society ehrt Gary Lewin
Die Physiological Society hat Professor Gary Lewin schon zu Beginn seiner Karriere geprägt. In seiner Zeit an den Universitäten Sheffield und London nahm er wiederholt an Treffen teil, die diese älteste physiologische Gesellschaft der Welt mehrmals im Jahr organisierte. „Es gehörte zur Tradition dieser Zusammenkünfte, dass junge Forscherinnen und Forscher über ihre Arbeit berichteten und sich anschließend der harschen Kritik und den wirklich immer sehr bohrenden Nachfragen der Zuhörenden stellen mussten“, erzählt der Leiter der Arbeitsgruppe „Molekulare Physiologie der somatosensorischen Wahrnehmung“ am Berliner Max Delbrück Center. Das sei hart gewesen, habe ihn aber exzellent auf spätere Vorträge vorbereitet, sagt Lewin.
Max Delbrück Center –Forschung mit dem Blick auf die kleinen wichtigen Dinge
Im Max Delbrück Center blicken die Wissenschaftler*innen ins Kleine – ohne das große Ganze zu vernachlässigen und betreiben Grundlagenforschung auf molekularer Ebene. In diesem Jahr feiert die renommierte Einrichtung ihr 30-jähriges Bestehen.
Als kurz nach der Wiedervereinigung viele Wissenschaftsinstitutionen in der DDR aufgelöst wurden, bekam der Heidelberger Mediziner Detlev Ganten einen Auftrag: Er sollte am nordöstlichen Stadtrand der Bundeshauptstadt, wo mehrere Akademie-Institute angesiedelt waren, ein neues Forschungszentrum etablieren, das auf bestehende Forschungseinrichtungen zurückgreift, Synergieeffekte schafft sowie Wissen und Forschung bündelt. Die Aufgabe ist geglückt: 30 Jahre später ist das damals gegründete Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (Max Delbrück Center) ein international renommiertes biomedizinisches Forschungszentrum mit rund 1.800 Mitarbeitenden.
Das Forschungsgebiet des Namensgebers Max Delbrück ist bis heute Programm des Zentrums: Der Nobelpreisträger ist einer der Begründer der modernen interdisziplinären Genetik und Molekularbiologie. Seit 2019 hat das Max Delbrück Center, das eine von 18 Einrichtungen der Helmholtz-Gemeinschaft Deutscher Forschungszentren ist, neben dem Standort in Berlin-Buch einen zweiten Standort in Berlin-Mitte. In 88 Forschungsgruppen und 19 Technologieplattformen forschen die Mitarbeiter*innen im Programm „Systemmedizin und Herz-Kreislauf-Erkrankungen“.
Wo liegen die systemischen Ursachen für Krankheitsprozesse und Fehlentwicklungen?
In ihrer Arbeit blicken die Wissenschaftler*innen ins Kleine – ohne das große Ganze zu vernachlässigen: „Wir werfen einen detaillierten Blick auf die Ursachen von ganz unterschiedlichen Erkrankungen – Krebs oder Herzkreislauferkrankungen sind da nur Beispiele“, erklärt Professorin Maike Sander, die seit dem 1. November 2022 als Wissenschaftliche Vorständin und Vorstandsvorsitzende das Max Delbrück Center führt. „Unsere Teams betreiben Grundlagenforschung und detektieren mithilfe modernster Technologien in Genen und Proteinen, in Zellen, Geweben, Organen oder ganzen Organismen, wo die systemischen Ursachen für Krankheitsprozesse und Fehlentwicklungen liegen könnten. Dabei kann es um Entzündungsprozesse gehen, um Veränderungen im Mikrobiom, um geschädigte Blutgefäße oder auch um einen ganz bestimmten Signalweg, der gestört ist.“
Beispielsweise untersuchen die Forscher*innen mithilfe der Einzelzellsequenzierung und Künstlicher Intelligenz hunderttausende von menschlichen Herzzellen. Die Teams kartieren die Zellen und analysieren, wie es die Zellen des Herzens im Zusammenspiel schaffen, zuverlässig ihre Aufgaben zu erfüllen. Erste Vergleiche der Daten von gesunden und kranken Herzen zeigen dabei, dass auch in der Kardiologie personalisierte Therapien nötig sind. Herzversagen ist nicht gleich Herzversagen.
Solche Erkenntnisse werden durch moderne Technik möglich. „Heute arbeiten wir computergestützt mit Big Data und Künstlicher Intelligenz, und das interdisziplinär“, sagt Maike Sander. Die Wissenschaftler*innen nutzen und entwickeln hochmoderne Infrastruktur: Organoid- und Stammzell-Plattformen, Kryo-Elektronenmikroskopie, das Präklinische Forschungszentrum oder Proteomik- und Omics-Ansätze.
Enge Zusammenarbeit mit Akteuren aus Berlin
„Wir wollen unsere Erkenntnisse möglichst schnell in die Anwendung und damit letztlich zum Krankenbett bringen. Uns geht es um Innovationen für die Medizin von morgen“, sagt Sander. Doch bis aus Grundlagenforschung ein Medikament oder eine nutzbare Technologie entwickelt wird, könne es oft lange dauern. Erfolge gelingen heutzutage nur in Kooperation. „Wir arbeiten in Berlin eng und erfolgreich mit vielen anderen zusammen – allen voran dem Berlin Institute of Health (BIH), unserem starken klinischen Partner, der Charité, dem DZHK und den Universitäten“, sagt Sander. „International sind wir ebenfalls bestens vernetzt.“
In Berlin arbeitet ein Großteil der Beschäftigten auf dem Campus Buch – auch „der Gesundheitsstandort“ genannt. Das 32 Hektar große Gelände hat eine über 100-jährige Tradition. „Der Biotechpark bietet optimale Bedingungen für unsere Teams. Hier wird im nächsten Jahr mit dem BerlinBioCube ein Gründerzentrum eröffnet, und unsere Partner vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie sitzen direkt nebenan“, sagt Sander.
Ähnlich wie auf dem Campus Buch schätzt Maike Sander auch das gesamte Ökosystem in der Metropolregion Berlin, in dem ihrer Meinung nach vieles gut ineinandergreift: „Dutzende Institutionen mit lebenswissenschaftlicher Orientierung sind hier angesiedelt, wir haben exzellente Universitäten, es gibt KI-Know-how, die Charité und dazu kommen die vielen außeruniversitären Forschungseinrichtungen. All das ist auf engem Raum versammelt – beste Voraussetzungen für Spitzenforschung und Innovation.“
Das 30-jährige Jubiläum wird am Max Delbrück Center mit einer großen Geburtstagsfeier für interne und externe Wegbegleiter am 7. Dezember begangen. Für die nächsten Jahre gibt es bereits einige Pläne: So soll in Buch ein Optical-Imaging-Center entstehen. „Wissenschaft bleibt nie stehen“, sagt Sander. „Wir wollen uns immer weiterentwickeln.“
Quelle:
HealthCapital Newsletter Dezember 2022
Max-Delbrück-Centrum für Molekulare Medizin
Max Delbrück Center feiert 30-jähriges Bestehen
Mit der Amtseinführung von Maike Sander als neue Wissenschaftliche Vorständin hat das Max Delbrück Center in Berlin am 7. Dezember seinen 30. Geburtstag gefeiert. Die Diabetesforscherin wirbt dafür, wissenschaftliche Spitzenleistung und Innovationen besser mit medizinischer Anwendung zu verzahnen.
Zum Fest kamen rund 300 Gäste aus Politik, Wissenschaft und Gesellschaft: Am Mittwoch, dem 7. Dezember 2022 hat das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft unter dem Motto „Discovery for tomorrow’s medicine“ sein 30-jähriges Bestehen gefeiert. Die neue Wissenschaftliche Vorständin, Professorin Maike Sander, entfaltete zum Amtsantritt ihre Vision für das Max Delbrück Center: „Grundlagenforschung, wie wir sie hier am Max Delbrück Center vorantreiben, erschließt Neuland für die Medizin. Sie macht Therapien nicht nur passgenauer, sie ermöglicht ganz neue Perspektiven“, sagt Sander.
„Mit Publikationen in Spitzenjournalen ist es allerdings nicht getan. Innovation entfaltet erst ihre Wirkung, wenn sie ihren Weg in die Anwendung findet. Hier in der Gesundheitsstadt Berlin haben wir dafür beste Voraussetzungen: starke klinische Partner wie die Charité, das Berlin Institute of Health, eine aufstrebende Biotech-Szene, Inkubatoren für Start-ups.“ Wie wichtig ein solches Umfeld ist, betont Maike Sander mit Blick auf ihre Erfahrungen und die Biotech-Branche im Silicon Valley und in San Diego. Die Diabetesforscherin hat fast drei Jahrzehnte in den Vereinigten Staaten gearbeitet. „Kein Labor, kein Zentrum kann seine Ideen allein verwirklichen. Wir arbeiten Hand in Hand, und der Gedankenaustausch beflügelt. Meine Priorität wird sein, gemeinsam mit den Partnern Hürden für die medizinische Anwendung zu senken und die Transfer-Infrastruktur zu stärken. So legen wir den Grundstein für die Medizin von morgen.“
Von Kalifornien nach Berlin: Maike Sander
Als Medizinstudentin in Heidelberg hatte Maike Sander gerade ihre Dissertation begonnen, als sie 1991 ein Forschungsaustausch nach San Francisco führte. Vier Monate wollte sie in Kalifornien bleiben. Es wurden fast 30 Jahre daraus, zunächst an der University of California in San Francisco, später in Irvine und ab 2008 in San Diego. „Ich habe in den USA zwei Dinge erkannt: Ich liebe die Wissenschaft und ich löse gern gemeinsam mit klugen Menschen aus aller Welt Probleme. Unabhängig von Hierarchie-Ebenen“, sagt sie. Die offene Atmosphäre beflügelte sie.
07. Dezember 2022; 16:30 – 20:00 Uhr
FESTAKT
Amtseinführung Prof. Maike Sander & 30 Jahre MDC
Campus Berlin-Buch, MDC.C; Robert-Rössle-Strasse 10
Bekannt wurde Sander mit wegweisender Diabetes-Forschung insbesondere zu den insulin-produzierenden Beta-Zellen. Beta-Zellen sind in den Langerhans-Inseln der Bauchspeicheldrüse zu finden und spielen eine zentrale Rolle bei der Kontrolle des Blutzuckerspiegels. Bei Typ-1 Diabetes zerstört das Immunsystem die Betazellen, bei Typ-2 Diabetes dagegen verlieren die Betazellen ihre Funktion und verursachen so einen Insulinmangel.
Im Fokus: Beta-Zellen
Um zu verstehen wie sich die Betazellen entwickeln, welche molekularen Mechanismen zu Diabetes führen und wie man Fehlfunktionen dieser Zellen korrigieren kann, kombiniert ihr Team Methoden aus Genetik, Genomik, Stammzellforschung und Biotechnologie. Die Wissenschaftlerinnen und Wissenschaftler produzieren aus menschlichen pluripotenten Stammzellen Bauchspeicheldrüsen-Inseln. Diese Organoide bilden die natürliche Mikroumgebung der Beta-Zellen in der Petrischale nach und erlauben detaillierte Analysen. Betazellen zu regenerieren oder mithilfe von menschlichen pluripotenten Stammzellen zu ersetzen, könnte in Zukunft für beide Formen von Diabetes ein Therapieansatz sein.
Quelle: Max-Delbrück-Centrum für Molekulare Medizin/Nachrichten
Ein Altmeister der Krebsforschung
Mehrere Dekaden lang hat Walter Birchmeier erforscht, wie sich Zellen in Geweben organisieren und wie diese Prozesse bei Krebserkrankungen durcheinandergeraten. Kurz vor Ende des dritten Jahrzehnts am Max Delbrück Center geht der Zellbiologe nun im Alter von 80 Jahren in den Ruhestand.
Wenn jemand von Anfang an dabei war und eine Institution entscheidend beeinflusst, ihr sozusagen seinen Stempel aufgedrückt hat, dann spricht man von einem Urgestein. Ein solches Urgestein ist Walter Birchmeier, der Leiter der Arbeitsgruppe „Signalvermittlung in Krebsentstehung und Entwicklung“ am Max Delbrück Center. „Als wissenschaftlicher Vorstand hat er das Max Delbrück Center ganz wesentlich geprägt. Und in der Krebsforschung hat er mit seinen molekular-mechanistischen Studien Maßstäbe gesetzt“, sagt Professor Claus Scheidereit, der von 2009 bis 2020 die Krebsforschung am Max Delbrück Center koordiniert hat. Im Alter von 80 Jahren verabschiedet sich Walter Birchmeier nun in den Ruhestand.
Walter Birchmeier kam 1993, kurz nach der Gründung des Instituts, als Gruppenleiter ans Max Delbrück Center. In den ersten Jahren des Instituts, das als Nachfolgerin dreier Forschungseinrichtungen der Akademie der Wissenschaften der DDR gegründet worden war, sei der Selbstfindungsprozess zwischen Ost und West nicht immer einfach gewesen, erinnert sich der Zellbiologe. Gründungsdirektor Detlev Ganten habe ihn zu allen Sitzungen dazu geholt, um zwischen ost- und westdeutschen Kolleg*innen zu vermitteln: „Dabei hat mir wahrscheinlich geholfen, dass ich der einzige Schweizer am Institut und damit weniger verdächtig war, irgendjemanden überrennen zu wollen“, sagt er und schmunzelt. Seit 1996 hat er eine Professur an der Charité – Universitätsmedizin Berlin inne. 1998 wurde er stellvertretender Wissenschaftlicher Vorstand des Max Delbrück Centers, von 2004 bis 2008 war er Wissenschaftlicher Vorstand.
Aktuelles vom MDC, Campus Berlin-Buch
Virenfahndung in der Kanalisation
Nicht nur das Coronavirus verändert permanent sein Gesicht, um sich den Angriffen des menschlichen Immunsystems möglichst zu entziehen. Auch andere Erreger nutzen diese Strategie: Durch winzige Veränderungen in ihrem Erbgut, den Mutationen, bringen sie immer wieder neue Varianten hervor, denen die Körperabwehr oft weniger entgegenzusetzen hat als den Erregern, die sie schon durch eine Infektion oder Impfung kennt.
Forschung als Perspektive für Ukrainerinnen
Dr. Ilona Miaschenko lebte bis vor wenigen Monaten in Tschernihiw. Die Stadt im Nordosten der Ukraine gehörte zu den ersten, die im Frühjahr 2022 von der russischen Armee angegriffen wurden. Vor einem halben Jahr floh die Bakteriologin mit ihrer Mutter und ihrem dreijährigen Sohn nach Niedersachsen, Deutschland. „In der Ukraine arbeitete ich in einem medizinischen Labor. Mich interessiert, wie Forschung in Deutschland organisiert ist und ob die Tätigkeit in einem wissenschaftlichen Umfeld eine Option für mich wäre“, erzählt Ilona Miaschenko.
BR50 verstärkt Zusammenarbeit
Berlin Research 50 ist mit der Gründung eines Vereins eine eigene Rechtspersönlichkeit und kann so die Mitgliedseinrichtungen noch stärker bei der Vernetzung untereinander sowie mit weiteren wissenschaftlichen Akteur*innen in Berlin unterstützen, auch als Vertreterin für die Belange der Außeruniversitären. Erklärtes Ziel bleibt es, den Forschungsraum Berlin weiter zu entwickeln und zu stärken. Zur offiziellen Vereinsgründung versammelten sich am 4. Oktober 2022 Vertreter*innen der Einrichtungen am Wissenschaftszentrum für Sozialforschung Berlin (WZB). Dem Verein gehören nach der Gründung nun 27 Forschungs- und Wissenschaftseinrichtungen, darunter Leibniz- und Max-Planck-Institute, Helmholtz-Zentren und Ressortforschungseinrichtungen des Bundes an. Weitere außeruniversitäre Einrichtungen in Berlin sind dem Verein als Partner im Netzwerk verbunden.
Quelle: MDC/Nachrichten
Labor trifft Lehrer:in – digital! Das Programm für 2022/23
Das Fortbildungsformat Labor trifft Lehrer:in – digital! des Max-Delbrück-Centrums für Molekulare Medizin in der Helmhotz-Gemeinschaft (Max Delbrück Center) bietet im Schuljahr 2022/23 biomedizinische Kurse zur aktuellen Forschung für Lehrerinnen und Lehrer an. Diese finden einmal im Monat unter der Leitung von Forschungsgruppen am Max Delbrück Center statt. Jeweils von 16:00 bis 17:30 Uhr lädt das Max Delbrück Center in seine virtuellen Labore ein. Nach einem circa 45-minütigen Vortrag startet die Diskussion und Fragen können gestellt werden.
Programm:
28. September 2022, 16:00 – 17:30 Uhr
Autoimmunkrankheiten in der Niere
Dr. Dörte Lodka
Autoimmunkrankheiten ++ Immunabwehr ++Autoimmunantwort ++ therapeutische Ansätze
23. November 2022, 16:00 – 17:30 Uhr
Understanding disease in 3D
Dr. Angélica García Pérez
organoids ++ stem cells ++ modeling disease ++ spinal muscular atrophy ++ amyotrophic lateral sclerosis
30. November 2022, 16:00 – 17:30 Uhr
Modifizierung von Genen mit Hilfe der CRISPR/ Cas-Methode – Chancen und Risiken für die Medizin
Prof. Dr. Ralf Schülein
CRISPR/Cas-Methode ++ Gen-Modifikationen ++ Molekularbiologie ++ Anwendungsbeispiele ++ medizinischer Nutzen
11. Januar 2023, 16:00 – 17:30 Uhr
Human brain organoids as a novel tool for modeling of brain development and neurological disorders
Dr. Agnieszka Rybak-Wolf
modeling human brain development ++ stem cells ++ organoid technology ++ brain organoids ++ brain disorders
08. Februar 2023, 16:00 – 17:30 Uhr
Stoffwechselregulation und die Auswirkung auf Zelldifferenzierung und Krebsentstehung
Dr. Stefan Kempa
Proteomik ++ Metabolomik ++ Stoffwechselregulation ++ Krebsforschung
19. April 2023, 16:00 – 17:30 Uhr
Digital Health mit Ultrahochfeld – Magnetresonanz und KI
Prof. Dr. Thoralf Niendorf
Bildgebende Verfahren ++ KI ++ Aufnahmen des Körperinneren++ Technologie ++ digital health
03. Mai 2023, 16:00 – 17:30 Uhr
Viren-Schatzsuche im Berliner-Abwasser
Dr. Emanuel Wyler
Abwassermonitoring ++ SARS-CoV-2 ++ Virusmutationen ++ Frühwarnsystem
Link zu Programm und Anmeldung: https://www.mdc-berlin.de/de/ltl
Neue Nachrichten vom MDC
SARS-CoV-2 kann Chronisches Fatigue-Syndrom auslösen
, dass SARS-CoV-2 das Chronische Fatigue-Syndrom (ME/CFS) auslösen kann. Die Forschenden beschreiben zudem ein ähnliches Krankheitsbild mit vermutlich anderer Ursache.
Gemeinsame Pressemitteilung mit der Charité – Universitätsmedizin Berlin
„Bereits in der ersten Welle der Pandemie entstand der Verdacht, dass COVID-19 ein Trigger für ME/CFS sein könnte“, sagt Professorin Carmen Scheibenbogen, kommissarische Direktorin des Instituts für Medizinische Immunologie am Charité Campus Virchow-Klinikum. Sie leitet das Charité Fatigue Centrum, das auf die Diagnostik von ME/CFS (Myalgische Enzephalomyelitis / Chronisches Fatigue-Syndrom) spezialisiert ist – eine komplexe Erkrankung, die unter anderem von bleierner körperlicher Schwäche geprägt ist. Das Zentrum wurde bereits im Sommer 2020 von den ersten Patient*innen nach einer SARS-CoV-2-Infektion aufgesucht. Seither mehren sich die Hinweise auf einen ursächlichen Zusammenhang zwischen COVID-19 und der Erkrankung ME/CFS, die oft zu einem hohen Grad körperlicher Beeinträchtigung führt.
DNA-Klau stärkt die Immunvielfalt
Vor einigen Jahren machten Professorin Kathrin de la Rosa und ihre Kolleg*innen im Labor des Schweizer Immunologen Antonio Lanzavecchia eine ungewöhnliche Entdeckung. Das Team stieß im Blut von Malaria-Patient*innen auf Antikörper, für deren Herstellung der Bauplan eines Gens verwendet worden war, das eigentlich eine völlig andere Aufgabe besaß. „Gewöhnlich kodiert dieses Gen für einen Rezeptor, der das Immunsystem bremst – was der Malaria-Erreger wahrscheinlich nutzt, um sich leichter zu vermehren“, erklärt die Leiterin der Arbeitsgruppe „Immunmechanismen und humane Antikörper“ am Berliner Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) und dem Berlin Institute of Health in der Charité (BIH).
CRISPR-basierte Schnelltests für Herzinfarkt & Krebs
Antigen-Schnelltests kennt seit der Pandemie fast jeder. Sind virale Eiweißfragmente in einem Abstrich enthalten, binden Antikörper sie auf einem Teststreifen und eine Bande entsteht. Sollen dagegen typische Erbgutbestandteile (RNA oder DNA) nachgewiesen werden, sind aufwändigere Verfahren wie die PCR nötig. Das Erbgut muss zuerst aufbereitet und vervielfältigt werden. Solche Tests dauern länger und sie sind nur in einem entsprechenden Labor möglich.
Quelle: MDC/Pressemitteilungen
Neues vom MDC, Campus Buch
Neues vom MDC
Kräfte bündeln, Veränderungen erreichen
Von den angestellten 833 Wissenschaftler*innen (Stand: 2021), die am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) tätig sind, sind etwa 400 Doktorand*innen. 150 davon sind als Gäste am MDC. Ihre Interessen vertreten die PhD Representatives, derzeit neun an der Zahl. Mit drei von ihnen haben wir über ihre Triebfeder gesprochen, sich in der Doktorand*innen-Vertretung des MDC zu engagieren. Miriam Wandres forscht seit 2020 in der Arbeitsgruppe „Systembiologie von Gen-regulatorischen Elementen“ von Professor Nikolaus Rajewsky am Berliner Institut für Medizinische Systembiologie (BIMSB) des MDC. Somesh Sai ist seit 2019 bei der Genomik-Plattform unter der Leitung von Dr. Janine Altmüller, ebenfalls am BIMSB, tätig. Und Tijana Perovic ist in ihrem letzten PhD-Jahr; seit 2018 forscht sie in der Arbeitsgruppe „Integrative vaskuläre Biologie“ von Professor Holger Gerhardt auf dem Campus Buch. Miriam Wandres und Tijana Perovic wurden im vergangenen Jahr zu PhD- Representatives gewählt, Somesh Sai ist seit drei Jahren dabei.
Ungebremst gegen Blutkrebs
Für Menschen mit bestimmten Leukämieformen, Lymphomen oder Multiplem Myelom, sind sie manchmal die letzte Chance, den Krebs zu besiegen: Behandlungen mit chimären Antigenrezeptor-T-Zellen, kurz: CAR-T-Zellen. Dazu werden den Patient*innen T-Zellen aus dem Blut entnommen, um diese außerhalb des Körpers mit künstlich hergestellten Rezeptoren, den CARs auszustatten. Als Wächter des Immunsystems patrouillieren T-Zellen permanent durch Gefäße und Gewebe, um körperfremde Strukturen aufzuspüren. Durch die CARs können sie zusätzlich ganz bestimmte Oberflächenstrukturen auf Krebszellen erkennen. Via Infusion dem oder der Patient*in zurückgegeben, zirkulieren sie dann als „lebendes Medikament“ im Körper, binden hochspezifisch an Tumorzellen und zerstören sie.
Die Reparaturtricks des Zebrafischs
Wenn ein Mensch einen Herzinfarkt erleidet und nicht schnell behandelt wird, sterben durch den Sauerstoffmangel geschädigte Herzmuskelzellen ab. Es bildet sich Narbengewebe. Weil sich daraus keine neuen Herzmuskelzellen (Kardiomyozyten) entwickeln können, sinkt die Pumpleistung des Herzens. Ganz anders bei niederen Wirbeltieren wie dem Zebrafisch: Er kann Organe regenerieren – auch sein Herz.
Profiling für Zellen
Einzelzellanalysen liefern eine Fülle molekularer und genetischer Informationen. Mit Hilfe des maschinellen Lernens führt ein Team um MDC-Forscher Uwe Ohler diese Daten zusammen und erstellt aussagekräftige Profile der Zellen. Die Chan Zuckerberg Initiative (CZI) fördert das Projekt nun.
Trotz ihrer winzigen Größe ist jede einzelne Zelle ausgesprochen komplex. So liest sie etwa aus riesigen DNA-Bibliotheken im Zellkern die Erbinformationen aus, die sie gerade benötigt, übersetzt sie in RNA und schließlich in eine große Vielfalt an Proteinen. Mit unterschiedlichen Techniken lassen sich heute die Eigenschaften und Zustände von Zellen in einem nie dagewesenem Detailreichtum charakterisieren. So können Wissenschaftler*innen etwa die DNA und ihre zugehörigen Genschalter auslesen, die RNA analysieren oder die unterschiedlichen Proteine und ihre Formen ermitteln. Das Problem dabei: man hat am Ende riesige Datenmengen, die vollkommen unterschiedliche Aspekte der Zelle beschreiben. Und selbst wenn es sich eigentlich um die gleichen Informationen vom gleichen Zelltyp handelt, unterscheiden sich die Daten voneinander – abhängig davon, in welchem Labor, zu welchem Zeitpunkt und mit welcher Technik sie gewonnen wurden.
Quelle: MDC/Pressemitteilungen
Pride-Symposium in den Naturwissenschaften
Einladung: Pride in den Naturwissenschaften
Kurz vor dem Christopher Street Day in Berlin findet am MDC zum ersten Mal ein Pride-Symposium statt. Am 22. Juli 2022 sind alle willkommen, die sich über queere Themen in den Naturwissenschaften und in der Gesundheitsversorgung austauschen wollen.
Mehr Sichtbarkeit für Wissenschaftler*innen mit unterschiedlichen Geschlechtsidentitäten oder sexuellen Orientierungen (LGBTQ+) – das wünschen sich die Organisator*innen des ersten Pride-Symposiums am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC). Mit einem Mini-Symposium wollen sie am 22. Juli 2022 Kolleg*innen aus der Wissenschaft, aber auch Bürgerinnen, Bürger und Journalist*innen aus Berlin informieren und sich über Themen auszutauschen, die für die LGBTQ+ Community in den Lebens- und anderen Naturwissenschaften besonders relevant sind.
Auf dem Programm stehen vier Fachvorträge und eine Diskussionsrunde zur Sichtbarkeit von queeren Menschen in der Wissenschaft, zum Zugang von Transgender zur Gesundheitsversorgung und zur Frage, warum es kaum Forschung zu queeren Themen in den Naturwissenschaften gibt. Als Sprecher*innen sind Charlotte Brinkmann vom Leibniz-Institut für Gemüse- und Zierpflanzenbau geladen sowie Noah Adams von der Universität Toronto, Dr. Ahi Sema Issever und Dr. Thomas Stein von der Charité – Universitätsmedizin Berlin. Ebenfalls mit dabei ist Dr. Sofia Forslund, Arbeitsgruppenleiterin am MDC. Zum Abschluss können Teilnehmende sich in entspannter Atmosphäre auf der Dachterrasse austauschen.
Wann und Wo?
Das Pride-Symposium findet am Freitag, den 22.7.2022, von 15:30 bis 17:30 Uhr im Großen Konferenzraum am Berliner Institut für Medizinische Systembiologie (BIMSB) des MDC in der Hannoverschen Straße 28 in Berlin-Mitte statt. Vorträge und Diskussionen sind ausschließlich auf Englisch; eine Anmeldung ist erforderlich.
Weiterführende Informationen
- Veranstaltung: Pride at MDC (auf Englisch)
- Portrait von Sofia Forslund
Quelle: PM des MDC vom 18. 07. 2022
Was bei einer SARS-CoV-2-Infektion in der Lunge geschieht
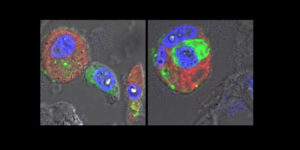
Mikroskopische Aufnahmen von Lungengewebe eines an COVID-19 Verstorbenen: Die Alveolarmakrophagen (rot, Zellkerne in blau) haben SARS-CoV-2-Virusmaterial (grün) aufgenommen. Zwischen diesen Fresszellen befindet sich eine Epithelzelle der menschlichen Lungenbläschen, die durch die Infektion aus dem Gewebeverband gelöst wurde (linkes Bild). Das rechte Bild illustriert, wie diese gestorbenen Zellen von Alveolarmakrophagen, neben dem Virusmaterial, aufgenommen und entsorgt werden.© Charité | Andreas Hocke
Wissenschaftler*innen weltweit erforschen den Mechanismus hinter einer COVID-19-Infektion und der damit manchmal einhergehenden Lungenentzündung und Lungenschädigung. Forscher*innen der Charité, des Berlin Institute of Health in der Charité (BIH), des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC), des Robert Koch-Instituts und der Freien Universität Berlin haben jetzt analysiert, wie sich die SARS-CoV-2-Viren in menschlichen Lungen vermehren und die Immunantwort aktivieren. Dazu haben sie die Zellen der menschlichen Lungenbläschen, auch Alveolen genannt, sowie die Alveolarmakrophagen in den Blick genommen. Diese Fresszellen unseres angeborenen Immunsystems vernichten fremde Partikel, darunter auch Infektionserreger wie Viren und Bakterien, und sorgen so für die Reinigung der Lunge.
Kein direkter Gewebeschaden durch SARS-CoV-2
Unter der Leitung von Prof. Dr. Andreas Hocke von der Medizinischen Klinik mit Schwerpunkt Infektiologie und Pneumologie der Charité hat das Forschungsteam herausgefunden, dass SARS-CoV-2 nur sehr wenige Epithelzellen, die die Oberfläche der Lungenbläschen auskleiden, infiziert und damit auch nur einen sehr geringen, direkten Gewebeschaden verursacht. Das stellt einen entscheidenden Unterschied etwa zu MERS-Coronaviren oder Influenzaviren dar. Gleichzeitig konnten die Wissenschaftler*innen belegen, dass der für SARS-CoV-2 notwendige ACE2-Rezeptor, der den Viren als Einstiegspforte dient, in nur sehr wenigen Alveolarepithelzellen nachweisbar ist. Das ergaben umfangreiche Analysen mittels spektraler Mikroskopie.
„Wir konnten die direkte Abhängigkeit von SARS-CoV-2 zu seinem Rezeptor in menschlichen Lungen sowie in Lungenorganoiden – das sind Modelle menschlicher Lungenbläschen, die wir aus Stammzellen des Lungengewebes gewonnen haben – zeigen und damit andere, alternative Rezeptoren ausschließen“, erklärt die Erstautorin der Studie Dr. Katja Hönzke von der Medizinischen Klinik mit Schwerpunkt Infektiologie und Pneumologie. Gelangen große Virusmengen aus dem oberen Atemweg in die Lungenbläschen, so vermehren sich diese demnach nicht in hohem Maß in den ansässigen Epithelzellen der Lunge, wie das bei anderen schweren Virusinfektionen oft der Fall ist, sondern werden direkt von den Fresszellen aufgenommen.
Fresszellen nehmen die Viren auf
„Wir haben mit detaillierten bioinformatischen Analysen sowie anhand von Autopsiegewebe von an COVID-19 verstorbenen Personen gesehen, dass sich die Fresszellen durch die Aufnahme der Coronaviren verändern“, sagt der zweite Erstautor der Studie, Dr. Benedikt Obermayer-Wasserscheid vom BIH. Die Fresszellen geben Entzündungsbotenstoffe ab und können zum Teil sehr starke Entzündungskaskaden anstoßen. Ebenso beobachteten die Forscher*innen, dass sich das Virus in den Fresszellen des Immunsystems nicht vermehrt.
Prof. Hocke ordnet die Ergebnisse ein: „Unsere Studie deutet darauf hin, dass schwere Lungenschäden bei COVID-19 eher auf eine durch Makrophagen ausgelöste Immunaktivierung zurückzuführen ist als auf eine direkte Zerstörung der Lungenbläschen durch das Virus. Damit trägt sie wesentlich zum Verständnis der Entstehung von COVID-19 in der Frühphase einer möglichen Lungenentzündung bei und zeigt, warum SARS-CoV-2, im Gegensatz zu MERS-Coronaviren, in der Mehrzahl der Fälle einen eher moderaten Verlauf aufweist.“ Die Wissenschaftler*innen gehen davon aus, dass die lokalen Immunmechanismen im Atemgewebe die SARS-CoV-2-Viren in den allermeisten Fällen effizient beseitigen und die Entzündungsreaktion begrenzen. Geschieht das nicht, was möglicherweise durch individuelle Risikofaktoren beeinflusst wird, können in seltenen Fällen schwere und tödliche Verläufe die Folge sein.
Lungenmodelle als Alternative zu Tierversuchen
Prof. Hocke führt weiterhin aus: „Unsere eingesetzten Lungenmodelle zeigen in hervorragender Weise, wie Alternativen zu Tiermodellen, die auf menschlichen Zellen basieren, insbesondere bei der Erforschung zoonotischer Erkrankungen eingesetzt werden können. Das ist uns in enger Zusammenarbeit mit Charité 3R, unserer Einrichtung zur Entwicklung von Alternativen zu Tierversuchen, gelungen.“
Die Wissenschaftler*innen wollen nun patientenindividuelle Organoidmodelle untersuchen, um herauszufinden, wie allgemeine Risikofaktoren wie Alter, Geschlecht, Begleiterkrankungen und anderen Medikationen die Aktivierung der Entzündungsantwort beeinflussen. Mit diesen Kenntnissen ließen sich mögliche Therapieansätze identifizieren, die auf das Immunsystem abzielen.
Über die Studie
Gefördert wurde die Arbeit durch die Deutsche Forschungsgemeinschaft (DFG) im Sonderforschungsbereich „Angeborene Immunität der Lunge“ (SFB-TR84), der Einstein Stiftung Berlin (Einstein-Zentrum 3R) sowie im Rahmen des Verbundprojektes „Organspezifische Stratifikation bei COVID-19“ (Organo-Strat) durch das Bundesministerium für Bildung und Forschung (BMBF). Das Verbundprojekt ist Teil des Netzwerks Universitätsmedizin (NUM), das von der Charité initiiert wurde und koordiniert wird. Das NUM vereint die Kräfte der 36 Universitätsklinika in Deutschland.
Hönzke K, Obermayer B, Mache C, et al. Human lungs show limited permissiveness for SARS-CoV-2 due to scarce ACE2 levels but virus-induced expansion of inflammatory macrophages. Eur Respir J 2022; in press (https://doi.org/10.1183/13993003.02725-2021)
Links:
Medizinische Klinik mit Schwerpunkt Infektiologie und Pneumologie
Charité 3R – Replace | Reduce | Refine
Die Core Facility Bioinformatik am BIH
Quelle: PM des BIH vom 28. 06. 2022










